产品问题分析
产品问题分析
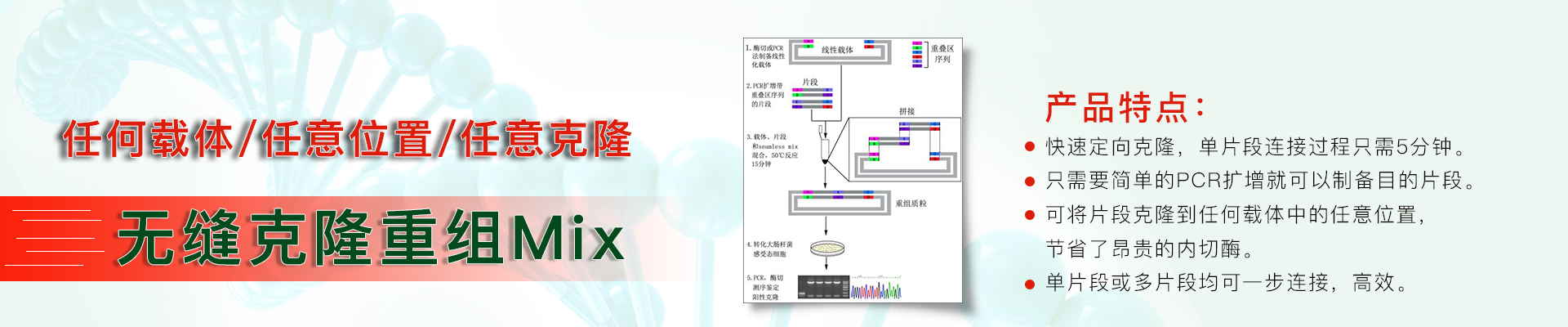
DNA纯化回收常见问题分析
发布者:博迈德生物2018-06-19 2409
2409
1、DNA产量低或者纯度不高
原因分析:漂洗液中没有加无水乙醇
建议解决方法:第一次实验时,在漂洗液中加入指定量的无水乙醇。
原因分析:试剂盒储存在非最佳条件
建议解决方法:试剂盒存放在室温(15℃-20℃)。
原因分析|:使用了非最佳的洗脱液
建议解决方法:使用本试剂盒配套的洗脱液。
原因分析:试剂和回收液没有充分混匀
建议解决方法:加入每个试剂后都要充分混匀。
原因分析:使用的结合液不足
建议解决方法:确保回收液体积和结合液的比例是1:5。
原因分析:洗脱不完全
建议解决方法:使用2次洗脱缓冲液洗脱,合并两次洗脱液。
原因分析:起始的处理材料中DNA含量太低
建议解决方法:加大处理量,但注意不要少于30ul。
原因分析:回收的片段小于100bp或者大于10kb
建议解决方法:片段小于100bp或者大于10kb回收效率都会迅速降低,可尝试提高起始处理量。
2、DNA下游酶切不能切开或者酶切不完全
原因分析:缓冲液或者试剂暴露于减少它们有效性的条件下
建议解决方法:储存在室温(15℃-20℃)。每次用完后立刻盖紧盖子,以免溶液蒸发、pH改变和污染。
原因分析:乙醇抑制了酶切反应
建议解决方法:尽量除去漂洗液,空气中晾几分钟,让残留乙醇挥发。
3、洗脱液中不含DNA
原因分析:一些硅基质膜成分一起洗脱下来,抑制了酶切反应
建议解决方法:将洗脱的DNA溶液13000rpm再离心一分钟,小心取上清使用。
原因分析:在初始处理材料中没有PCR产物
建议解决方法:开始回收前,用琼脂糖凝胶/EB电泳检测PCR产物。
如果您还有其他技术疑问,欢迎随时拨打技术热线:010-52609502转8007;也可把您的技术问题发送到技术部邮箱:biomedsupport@163.com。
- •【新品】博迈德封板膜(自粘型)...
- •【新品】博迈德封板膜(压敏型)...
- •【新品】单体亲和素磁珠...
- •【新品】Thermolabile Uracil-DNA Glycosylase热敏UDG酶...
- •Protein L Magnetic Beads蛋白L磁珠...
- •Protein G Magnetic Beads蛋白G磁珠...
- •Protein A Magnetic Beads 蛋白A磁珠...
- •pBM28 Toposmart 克隆试剂盒...
- •Benzonase Nuclease 全能核酸酶...
- •核酸提取或纯化试剂(病毒DNA/RNA 纯化试剂盒(快速磁珠法))...
- •核酸提取或纯化试剂(病毒DNA/RNA纯化试剂盒(磁珠法))...
- •清洗液...
- •Ribonuclease A (RNase A)干粉...
- •dam-/dcm-感受态细胞...
- •【新品】GV3101(pSoup)农杆菌感受态细胞...

 商城
商城



 服务热线:13366569263
服务热线:13366569263 biomed2005@163.com
biomed2005@163.com
