克隆相关
EasyMut基因多点突变试剂盒
发布者:博迈德生物发布时间:2018-09-26 6729
6729
产品信息:
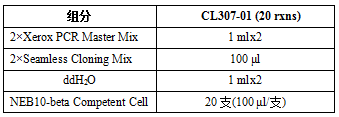
产品储存:请按产品指示温度保存各成分
产品介绍:
本产品利用无缝克隆技术来实现基因的定点突变,可用于单点突变和多点突变质粒的构建。本产品无需除去甲基化模板质粒,无需PCR扩增出整个质粒,并且引物设计更加简便快速,因此可以更加快速,高效地实现定点突变。
产品特点:
1. 利用2×Xerox PCR Master Mix扩增片段,缩短扩增时间(2-4 kb/min),提高保真性;
2. 引物设计更加简单,快速;
3. 省略消化甲基化模板质粒的步骤,更加快速,高效;
4. 无需PCR扩增出整个质粒,减少载体的突变。
实验原理:
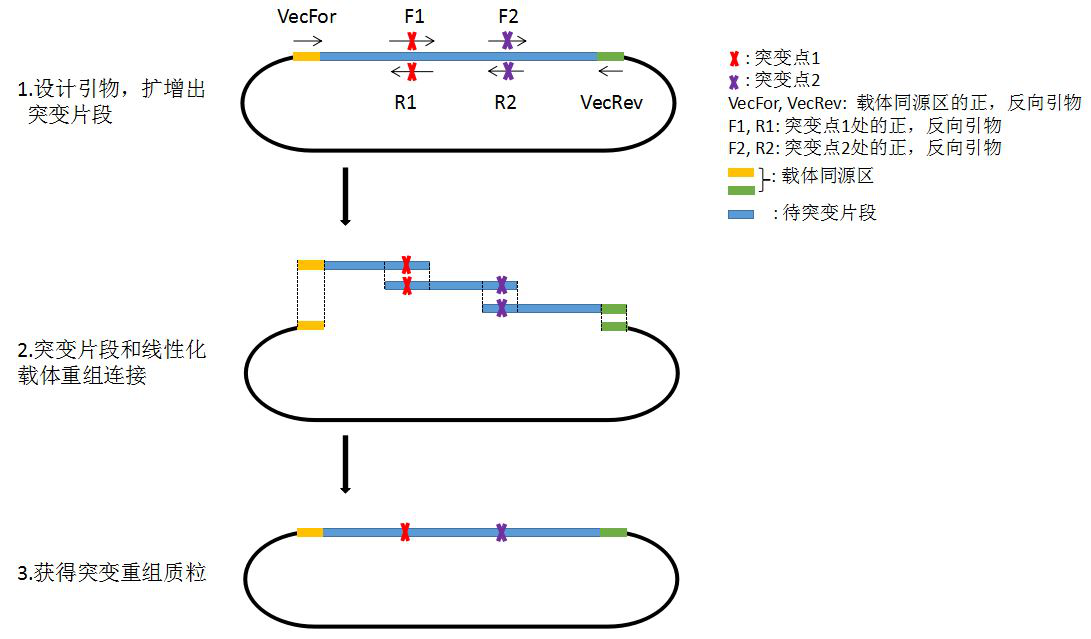
实验步骤:
一、突变位点的引物设计
1. 突变位点引物设计要求 :
(1)在每个突变位点处需设计一对引物,且突变位点在重叠区约中部位置。可以先设计正向引物,然后通过反向互补得到反向引物。
(2)引物的长度通常为30-40个碱基,突变位点两侧的碱基数在15-20个左右,GC%含量在40%-60%为最佳。
(3)避免引物末端为重复序列。
2. 引物设计示例:
(1)单点突变引物设计:如图1
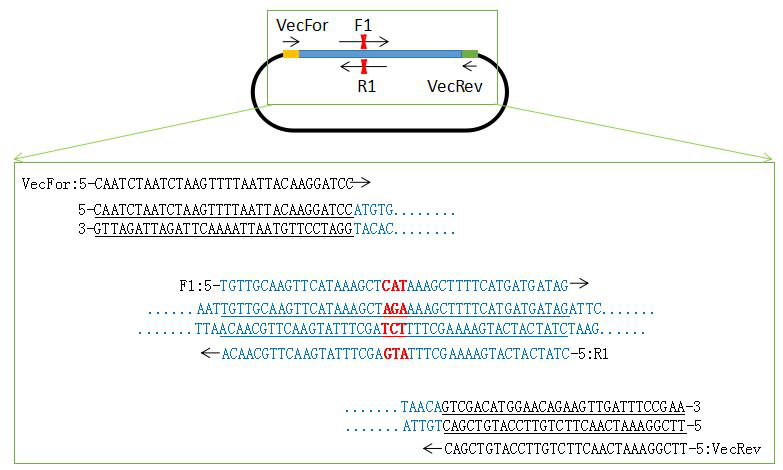
图1
(2)多点突变引物设计:如图2
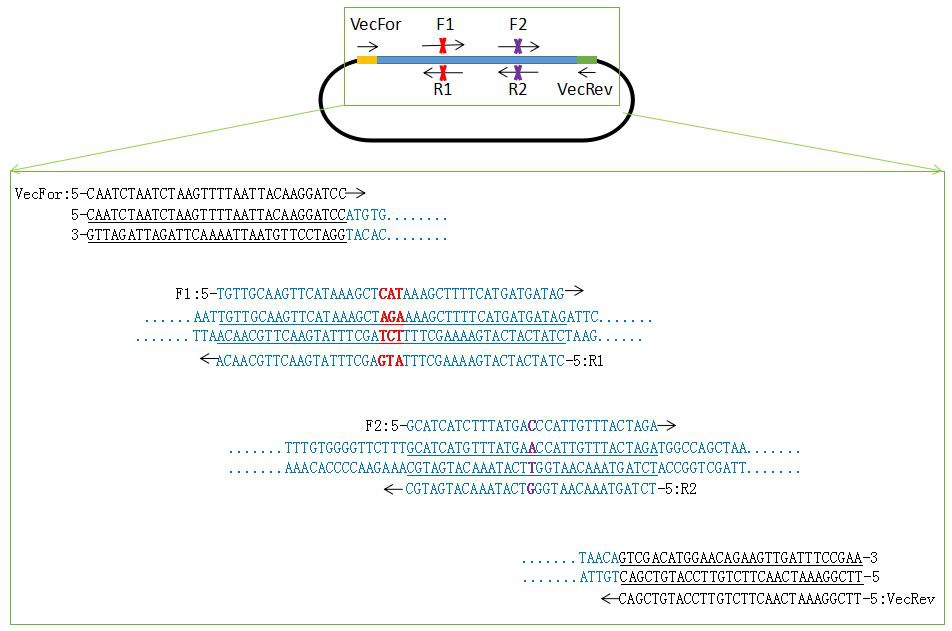
图2
二、突变片段的制备
1. PCR扩增
(1)PCR扩增体系
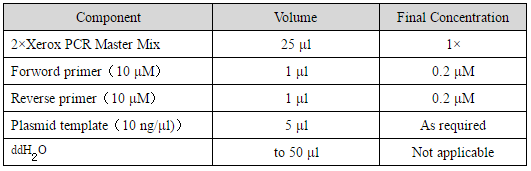
(2)PCR扩增条件
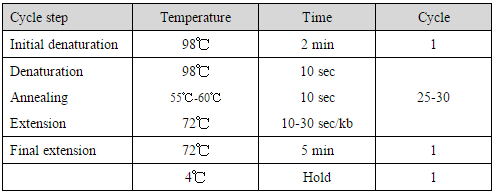
注意:为了获得更高保真性的扩增产物,采用高浓度模板和少量PCR循环数组合的扩增方法。
2. 纯化片段
(1)电泳检测:取10 μl PCR产物,根据片段大小选择合适浓度的琼脂糖凝胶电泳检测。
(2)如果扩增片段单一,建议用PCR产物纯化回收试剂盒纯化片段;如果有非特异扩增,建议使用琼脂糖凝胶纯化回收试剂回收片段。
三、线性化载体的制备
可以通过酶切或PCR扩增的方法来制备线性化载体,且最好使用空载体质粒进行酶切或PCR扩增。
1. 酶切获得线性化载体
利用单酶切或双酶切对空载体进行线性化处理,一般双酶切比单酶切线性化效果好。载体的完全线性化是无缝连接成功的关键。单酶切或双酶切方式制备的线性化载体无需进行末端脱磷酸化处理。通过电泳方法判定载体线性化是否完全时,一定要用未酶切的质粒做对照一起电泳。酶切完成后建议采用胶回收方法纯化线性化载体。
2. PCR扩增制备线性化载体
以空载体质粒为模板,设计一对引物用高保真DNA聚合酶(如Xerox)扩增,制备用于重组的线性化载体。为防止残留环状载体质粒对克隆阳性率的影响,可以采用胶回收方法或者Dpn I消化结合胶回收的方法纯化线性化载体。
四、突变片段与线性化载体的重组连接
连接体系:

轻轻混合,50℃反应15 min(2-3个片段,15 min;4个片段以上,60 min),反应完成后,将离心管放在冰上数秒。
连接产物可直接用于转化或放于-20℃保存。
五、转化
1. 从-80℃冰箱中拿出感受态细胞,放于冰上溶解;
2. 取5-10 μl连接产物加入到刚化冻的50 μl或100 μl感受态细胞中,轻轻混匀;
3. 冰上静置20-30 min;
4. 42℃,热击90 sec;
5. 冰上放置2 min;
6. 加入900 μl无抗性的LB液体培养基,200 rpm,37℃,培养60 min;
7. 4000 rpm 离心1 min,弃掉部分上清,保留100-200 μl,用吸头吹打悬浮菌体,取100 μl菌液涂在相应抗性板上,37℃倒置培养过夜。
六、阳性克隆鉴定
1. 菌落PCR方法;
2. 限制性酶切分析方法;
3. DNA测序方法
常见问题及解决方法:
1. 转化后没有克隆或克隆数少
(1)感受态细胞效率降低,请用pUC19检测一下感受态细胞的效率,确保转化效率在
108 cfu/μg以上。
(2)PCR扩增的突变片段产物进行胶回收纯化,确定其条带的大小和单一性。
2. 转化后菌落有很多空载体质粒
这种情况主要是由于线性化载体制备不好造成的。鉴定一下质粒的质量,保证质粒完全酶切。如果内切酶无效也会产生这种现象。
3. 测序没有信号
(1)检查送测序的质粒和原始质粒酶切后是否大小完全一致 。
(2)用测序引物对原始质粒测序,验证测序引物的有效性。
![]()
- •【新品】博迈德封板膜(自粘型)...
- •【新品】博迈德封板膜(压敏型)...
- •【新品】单体亲和素磁珠...
- •【新品】Thermolabile Uracil-DNA Glycosylase热敏UDG酶...
- •Protein L Magnetic Beads蛋白L磁珠...
- •Protein G Magnetic Beads蛋白G磁珠...
- •Protein A Magnetic Beads 蛋白A磁珠...
- •pBM28 Toposmart 克隆试剂盒...
- •Benzonase Nuclease 全能核酸酶...
- •核酸提取或纯化试剂(病毒DNA/RNA 纯化试剂盒(快速磁珠法))...
- •核酸提取或纯化试剂(病毒DNA/RNA纯化试剂盒(磁珠法))...
- •清洗液...
- •Ribonuclease A (RNase A)干粉...
- •dam-/dcm-感受态细胞...
- •【新品】GV3101(pSoup)农杆菌感受态细胞...

 商城
商城




 服务热线:13366569263
服务热线:13366569263 biomed2005@163.com
biomed2005@163.com
